FAQ专题|空间转录组常见问题合集
在最近公布的《2023年十大新兴技术报告》中,空间组学被评为十大新兴技术之一,其中的空间转录组测序(ST-seq)技术已成为探索细胞生物学未知领域的强有力工具。空间转录组可以揭示组织内的基因表达空间分布的异质性,为研究组织空间表达图谱、组织发育变化和疾病发生机制提供了新的视角。本次FAQ将聚焦讨论空间转录组技术在样本准备以及实验设计方面主要关心的问题。
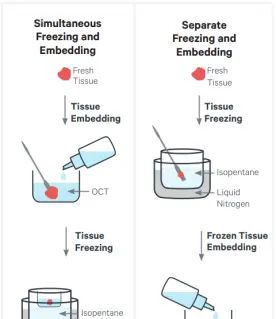
Q1:冷冻包埋样本做空间转录组应该怎么处理?
新鲜冷冻样本的包埋,是空间转录组的重大前处理步骤,一般可以采用以下两种方式进行包埋:
先冷冻后包埋法:新鲜组织样本取下后要迅速用预冷的镊子将新鲜组织浸没在异戊烷至组织完全冷冻,然后进行OCT包埋。
冷冻同时包埋:若无异戊烷,也可将包埋与冷冻同时进行。将新鲜组织放在培养皿中,加入室温的OCT包埋剂,让组织外包裹一层OCT,然后将组织置于包埋盒中并加入OCT包埋剂,最后放置在碎干冰上(或异戊烷中)冷冻。
Q2:样本能否直接液氮冻存?
不可以液氮直接速冻,直接液氮处理可能在沸腾过程中使组织周围形成空穴,导致不同区域降温不同步而改变内部形态,甚至组织碎裂。
Q3:石蜡包埋块可以存放多长时间?
石蜡样本在包埋和保存的过程中会产生许多降解RNA的因素,另外因时间和存放条件的不同,RNA降解的速率也不一样,因此无法仅仅依靠存放年限来判断样本是否可用。目前主要通过检测样本RNA的DV200(片段长度大于200nt的RNA比例)指标来确定,大于30%才可使用。
Q4:空间转录组适用的样品类型?
目前除了皮肤、骨头等特殊样本类型需要评估优化之外,大部分组织类型都可适用于空间转录组。根据样本处理方式,适用的物种类型也有不同:
鲜冷冻样本通过mRNA的ploy A结构进行捕获,可以适用于多个物种,包括:人类、小鼠、大鼠、斑马鱼等等。
10x Visium 版本的FFPE样本通过目标探针的方式进行mRNA捕获,仅适用于人类和小鼠样本。
华大Stereo-seq版本的FFPE样本通过随机探针的方式进行RNA捕获,适用于所有物种,可以同时检出非编码RNA以及微生物RNA。
Q5:与冷冻包埋样本相比,石蜡包埋样本有什么特点?
[if !supportLists]1) [endif]研究的性质不同,石蜡包埋样本可以保存的时间更加长久,可以对之前的样本进行回顾性研究,而新鲜冷冻包埋样本如果长期保存,可能会导致因冰晶形成而破坏组织结构,产生RNA弥散。
[if !supportLists]2) [endif]可以弥补部分组织样本透化效果不佳的缺点。石蜡包埋样本采用探针结合的方式捕获mRNA,无需经过透化实验摸索,对于透化效果不佳的组织类型,可以思考采用石蜡包埋的方式。
Q6:骨头样本是否可以进行空间转录组?
可以,但存在风险。一是骨头样本粘附性不强,容易脱片,一般需进行脱钙处理,以增强其在玻片上的粘附性。二是骨头样本的细胞密度低,细胞的RNA含量低,导致最终单个spot点捕获的细胞数少,中位基因数低。
Q7:植物样本是否可以做空间转录组?
植物样本可以通过ploy A结构进行捕获,但存在容易脱片的问题。同时植物样本内部结构复杂,存在多种不同的细胞类型,以及细胞壁的存在,这些都会增加透化过程的复杂性,可能还需要对透化试剂进行优化。另外,植物样本提议使用新生幼嫩的组织,成熟的组织RNA含量低,很少有基因表达。
Q8:做空间转录组需要几个生物学重复
目前做空间转录组是可以不做生物学重复的,一是空间转录组属于新兴的技术,就像单细胞转录组刚出现的时候,往往不会对生物学重复有明确的要求。二是空间转录组的生物学重复并不好实现,只有在样本的空间结构存在某种程度的一致性时才有可能实现。
Q9:关于肿瘤样本的研究,如何取样?
肿瘤作为全球主要的健康挑战之一,因其复杂的分子机制和治疗抵抗性,所以一直是医学研究的重点关注方向。对于肿瘤样本,一般可以采取以下两种取样方式:
1) 选取肿瘤与周边区域,这种取样方式侧重于研究肿瘤的微环境。通过空间转录组测序,比较肿瘤的核心区,侵袭前沿区,以及周边健康组织区域细胞组成比例的变化,挖掘关键的细胞互作以及分子调控机制。当肿瘤较小时,可以直接把肿瘤与周边健康区域一起检测。当肿瘤较大时,可能需要分别取肿瘤核心区,侵袭前沿区,以及周边健康区域进行检测。
2) 选取不同时间点/处理下的肿瘤样本,这种取样方式侧重于研究不同肿瘤之间的异质性。例如可以根据治疗效果,选择预后良好与预后效果不好的肿瘤作为比较。
Q10:单细胞+空间转录组联合,样本如何设计?
空间转录组可以实现转录本在组织空间位置的还原,但由于每个spot点或者每个bin里面是包含了若干个细胞(1-10个细胞)的转录本信息,因此没法确切知道该位置由哪些细胞构成。为了解决这一问题,目前有不少文章采用了单细胞结合的方式,通过不同的反卷积算法,推算出空间位置的细胞组成比例。关于与单细胞联合的实验设计,目前主要有以下几种方法。
1)收集样本的时候将样本一分为二,一份用于单细胞转录组,一份用于空间转录组。该方案需要样本为新鲜样本,且样本制备单细胞悬液效果好。但是需要注意样本的分割均匀,如果样本的细胞组成分布差异极大,该方法可能会导致两组学关联性下降,例如肿瘤可能就不太适用。
2)收集样本的时候,采用新鲜冷冻包埋的方式,先进行空间转录组的测序分析,剩余的样本先放-80度冰箱保存,根据空间转录组的结果,选择符合预期的样本后再对剩余的组织样本进行细胞核悬液制备。这种方式的好处是比较灵活,可以先根据空间转录组的结果再去做单细胞核转录组。但是这种处理方式的单细胞只能提细胞核悬液,对样本的保存要求比较高。
3)收集的样本只做空间转录组分析,单细胞数据选用已经公开发表的单细胞数据。这种方式好处是成本最低,但是不同样本之间会存在异质性,导致两组学关联性降低,并且受限于已经公开发表的数据集。
总的来说,如果经费允许的话,最好还是用前两种方式,样本的关联效果最好。如果经费有限,且该样本的单细胞数据丰富,也可采用第三种最具性价比的方式。
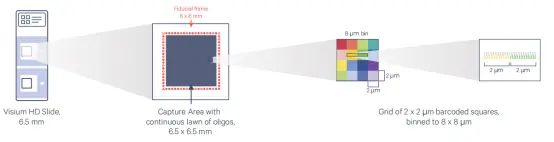
Q11:10x visium HD相比其他空间转录组技术有什么特点?
10x Visium HD对芯片结构进行了全新升级,芯片有两个捕获区域,每个捕获区域为6.5mm*6.5mm,每个区域由2μm*2μm的小正方形组成。该芯片主要有两大特点:
1)可以对组织无间隙覆盖,完整保留了组织所有区域的生物学信息;
2)以单细胞分辨率对组织进行全转录组空间分析;
该技术采用探针捕获的方式,针对人和小鼠分别设计了约18000个和19000个基因的探针对,目前仅适用于人和小鼠的FFPE样本。
Q12: 空间转录组与单细胞转录组做关联,样本是否需要一一配对?
空间转录组与单细胞转录组的联合,主要是利用单细胞转录组中不同细胞类型的表达矩阵数据,用于空间spot点的反卷积计算。因此,推荐每一种组织类型可以做一个单细胞转录组,即单细胞转录组和空间转录组中出现的细胞类型是重合的。例如,有几个空转的样本都来自于同一个患者的同一个组织,针对这几个样本可以只做一个单细胞转录组。
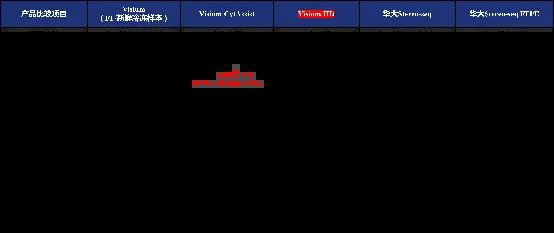
Q13:可以总结梳理目前不同空转技术的对比吗?
目前主流的空间转录组平台主要有10x Visium系列和华大Stereo-seq系列,两者都可以做FF样本(新鲜冷冻样本)和FFPE(石蜡包埋样本),具体技术对列如下:
本期的空间转录组测序常见问题解答就到这里啦,如果还有其他感兴趣的问题,也欢迎随时与我们联系,我们下期见~

















暂无评论内容