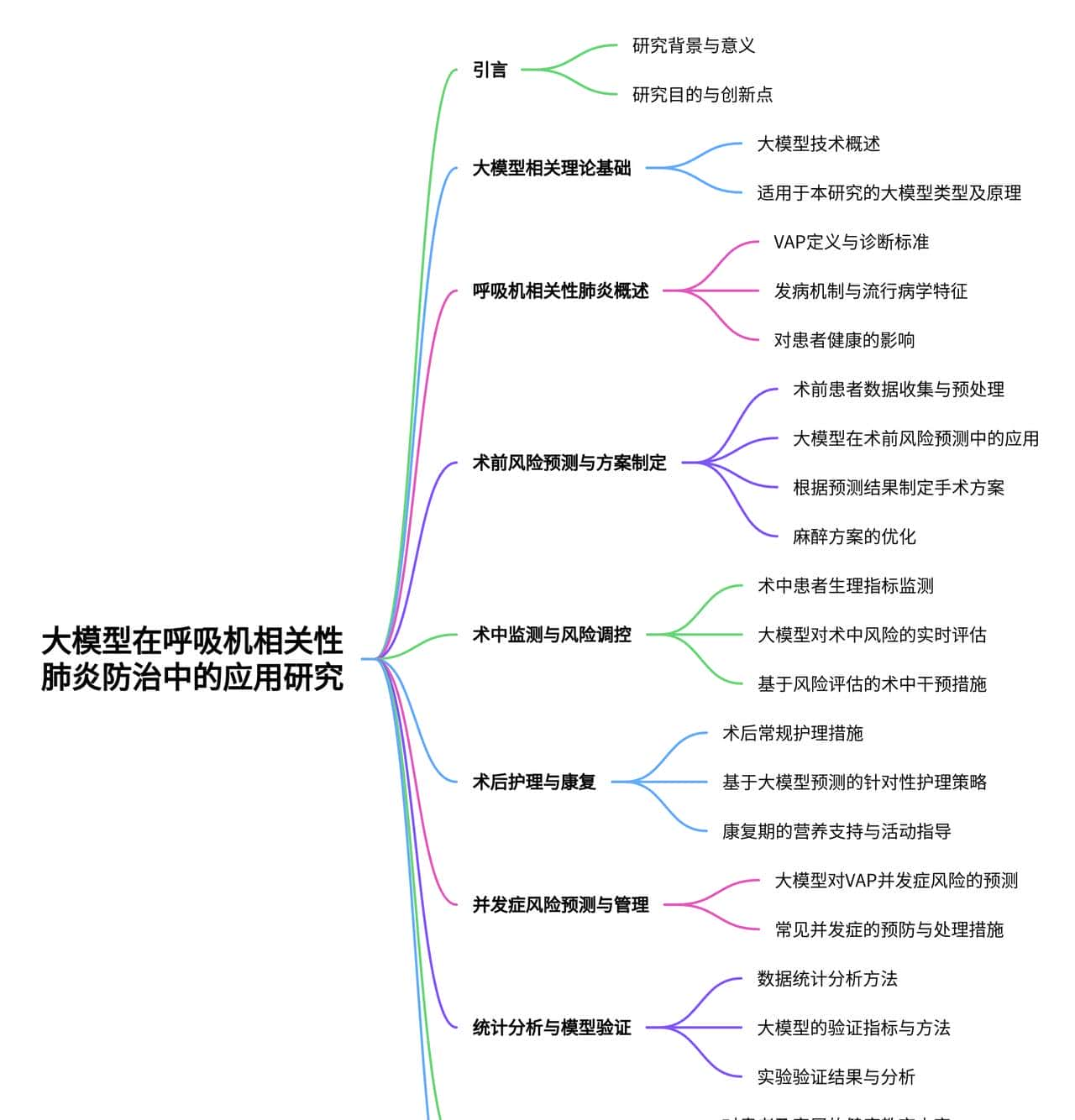
目录
一、引言
1.1 研究背景与意义
1.2 研究目的与创新点
二、大模型相关理论基础
2.1 大模型技术概述
2.2 适用于本研究的大模型类型及原理
三、呼吸机相关性肺炎概述
3.1 VAP 定义与诊断标准
3.2 发病机制与流行病学特征
3.3 对患者健康的影响
四、术前风险预测与方案制定
4.1 术前患者数据收集与预处理
4.2 大模型在术前风险预测中的应用
4.3 根据预测结果制定手术方案
4.4 麻醉方案的优化
五、术中监测与风险调控
5.1 术中患者生理指标监测
5.2 大模型对术中风险的实时评估
5.3 基于风险评估的术中干预措施
六、术后护理与康复
6.1 术后常规护理措施
6.2 基于大模型预测的针对性护理策略
6.3 康复期的营养支持与活动指导
七、并发症风险预测与管理
7.1 大模型对 VAP 并发症风险的预测
7.2 常见并发症的预防与处理措施
八、统计分析与模型验证
8.1 数据统计分析方法
8.2 大模型的验证指标与方法
8.3 实验验证结果与分析
九、健康教育与指导
9.1 对患者及家属的健康教育内容
9.2 教育方式与效果评估
十、结论与展望
10.1 研究成果总结
10.2 研究的局限性与未来研究方向
一、引言
1.1 研究背景与意义
呼吸机相关性肺炎(Ventilator – Associated Pneumonia,VAP)是指在机械通气 48 小时后至拔管后 48 小时内出现的肺炎,是危重病患者最常见的下呼吸道感染之一。机械通气作为抢救和治疗呼吸衰竭患者的重要手段,在临床广泛应用,但 VAP 的发生严重影响患者的预后,延长住院时间,增加医疗费用,甚至导致患者死亡率显著上升。研究表明,VAP 的发病率在机械通气患者中可达 30% – 70% ,其高发病率和高病死率给患者家庭和社会带来了沉重负担。
传统上,对于 VAP 的预测主要依赖于临床医生的经验和一些简单的临床指标,如患者的年龄、基础疾病、机械通气时间等,但这些方法存在很大的局限性,难以准确预测 VAP 的发生。随着人工智能技术的飞速发展,大模型凭借其强大的数据处理和分析能力,在医疗领域展现出巨大的应用潜力。大模型能够整合多源异构数据,包括患者的人口统计学信息、病史、生命体征、实验室检查结果、影像学资料等,通过对大量数据的学习和分析,挖掘出数据之间的潜在关联和规律,从而实现对 VAP 更准确的预测。利用大模型进行 VAP 风险预测,有助于临床医生在患者使用呼吸机的术前、术中、术后等各个阶段及时识别高风险患者,提前采取有效的预防和治疗措施,如优化手术方案、调整麻醉方式、加强术后护理等,这对于降低 VAP 的发生率,改善患者的临床结局,提高医疗资源的利用效率具有重要的临床意义和社会经济效益。
1.2 研究目的与创新点
本研究旨在利用大模型构建一套全面、精准的呼吸机相关性肺炎风险预测体系,实现对患者在使用呼吸机前(术前)、使用过程中(术中)以及停止使用后(术后)发生 VAP 风险的准确预测,并基于预测结果制定个性化的手术方案、麻醉方案、术后护理计划以及健康教育与指导策略,以降低 VAP 的发生率,改善患者的预后。
本研究的创新点主要体现在以下几个方面:
多阶段综合预测:不同于以往仅关注单一阶段 VAP 风险预测的研究,本研究将术前、术中、术后三个阶段纳入统一的预测框架,全面分析各阶段影响 VAP 发生的因素,构建多阶段连续的风险预测模型,为临床提供全流程的风险评估。
多源数据融合:充分利用大模型对多源异构数据的强大处理能力,整合患者的临床信息、检验检查数据、基因数据、影像数据等多维度数据,挖掘数据间的深层联系,提高预测的准确性和可靠性。
个性化方案制定:根据大模型预测的患者 VAP 风险程度,为每位患者量身定制个性化的手术方案、麻醉方案和术后护理计划,实现精准医疗,提高治疗效果。
实时动态监测与调整:借助大模型的实时计算能力,对患者使用呼吸机围治疗期的 VAP 风险进行动态监测,及时发现风险变化并调整相应的干预措施,确保患者得到最佳的治疗和护理。
二、大模型相关理论基础
2.1 大模型技术概述
大模型,通常指基于深度学习框架构建,拥有庞大参数规模的人工智能模型。其发展历程是一段充满突破与创新的技术演进史。早期,受限于计算能力和数据规模,模型的复杂度和泛化能力相对有限。随着硬件技术的飞速发展,尤其是图形处理单元(GPU)的广泛应用,为大规模数据的高效处理提供了可能;同时,海量数据的积累以及算法的不断优化,促使大模型逐渐崭露头角。从最初在自然语言处理、计算机视觉等领域的初步应用,到如今广泛渗透至各个行业,大模型展现出强大的通用性和适应性,成为推动人工智能发展的核心力量。
在医疗领域,大模型的应用正带来深刻变革。在医学影像诊断方面,大模型能够快速、准确地识别医学影像中的异常,如在 X 光、CT、MRI 影像中检测肿瘤、骨折等病变,辅助医生做出更精准的诊断决策 。在药物研发过程中,大模型可以通过对大量生物数据的分析,预测药物分子的活性和毒性,加速药物研发进程,降低研发成本。在疾病预测领域,大模型整合多源数据的能力使其能够全面分析患者的健康信息,挖掘潜在的疾病风险因素,从而实现对多种疾病的风险预测。例如,通过分析患者的基因数据、生活习惯、临床检验结果等信息,预测心血管疾病、糖尿病等慢性病的发病风险。大模型凭借其强大的数据处理和分析能力,为医疗领域的智能化发展提供了有力支持,展现出巨大的应用潜力。
2.2 适用于本研究的大模型类型及原理
本研究选用的是基于 Transformer 架构的深度学习大模型,Transformer 架构凭借其独特的自注意力机制,能够高效处理序列数据,在捕捉数据中的长距离依赖关系方面表现卓越,为模型理解复杂的语义信息和上下文关系奠定了坚实基础。其核心组件包括多头注意力机制、前馈神经网络等,多头注意力机制使得模型能够从不同角度对输入数据进行特征提取,前馈神经网络则负责对提取的特征进行进一步的非线性变换和特征组合,从而增强模型的表达能力。
在训练机制上,该模型采用了无监督预训练和有监督微调相结合的策略。在无监督预训练阶段,模型在海量的医疗文本数据、临床病例数据、医学影像数据等多源数据上进行训练,通过学习数据中的通用模式和特征表示,获取丰富的医学知识和语义理解能力,为后续的任务学习提供良好的初始化参数。随后,在有监督微调阶段,利用大量标注好的与呼吸机相关性肺炎相关的数据,包括患者发生 VAP 的病例信息、未发生 VAP 的对照病例信息以及对应的各种临床特征数据等,对预训练模型进行针对性的微调,使模型能够更好地适应 VAP 风险预测这一特定任务,提高模型在该任务上的预测性能。
在预测 VAP 风险时,模型的工作原理是将患者的术前信息(如年龄、性别、基础疾病、手术类型等)、术中信息(如麻醉方式、手术时长、术中出血量、呼吸机参数设置等)以及术后信息(如生命体征变化、实验室检查结果、用药情况、是否出现其他并发症等)作为输入,经过模型的多层神经网络结构进行特征提取和模式识别。模型通过对这些多阶段、多维度数据的深度分析,挖掘数据之间的潜在关联和复杂关系,学习到与 VAP 发生相关的特征模式。例如,发现某些基础疾病与特定手术类型组合下,VAP 的发生风险显著增加;或者某些术后生命体征的异常变化与 VAP 的发生存在密切联系。然后,模型根据学习到的这些特征模式,对输入数据进行综合评估,输出患者发生 VAP 的风险概率。
三、呼吸机相关性肺炎概述
3.1 VAP 定义与诊断标准
呼吸机相关性肺炎(VAP)被定义为患者接受机械通气 48 小时后发生的肺炎,或在撤机、拔管 48 小时内出现的肺炎,是医院获得性肺炎中的一种特殊类型 。其诊断是一个综合评估的过程,涉及临床症状、影像学检查以及微生物学检测等多个方面。
临床症状方面,患者通常会出现发热,体温超过 38℃或较基础体温高出 1℃以上,且难以用其他原因解释;呼吸道产生脓性痰液,或痰液性状明显改变,变得黏稠、有异味等;氧合状况恶化,表现为氧饱和度下降,需要增加吸氧浓度或改用更高浓度的氧疗手段来维持氧合。
影像学检查是重要的诊断依据之一,通过 X 线或 CT 检查,若发现肺部出现新发或进展性的浸润影,同时排除肺水肿、肺栓塞、肺结核等其他肺部疾病的可能,即可作为支持 VAP 诊断的有力证据。肺部实变在影像学上表现为局部肺组织密度增高,可伴有支气管充气征;胸腔积液也是 VAP 可能出现的影像学表现之一,尤其是在新发或进展性肺部浸润影的同侧。
微生物学诊断对于明确 VAP 的病原体,指导精准治疗至关重要。下呼吸道标本的采集方法包括支气管肺泡灌洗液、气管内吸引物、经气管导管吸取物等。采集过程需严格遵循无菌技术,以避免标本被污染,且尽可能在患者发病早期、使用抗生素之前进行采集。定量培养时,通常以 CFU/mL 为单位,规定≥10³CFU/mL 为阳性阈值;半定量培养则根据菌落数量进行分级,如大量生长、中量生长、少量生长等。对于可疑感染病例,往往需要进行多次培养,以提高阳性检出率。常见的病原体包括革兰阴性菌,如铜绿假单胞菌、肺炎克雷伯菌、大肠杆菌等;革兰阳性菌,如金黄色葡萄球菌、表皮葡萄球菌等;此外,真菌和病毒在某些情况下也可能引发 VAP,不过相对较少见。
临床肺部感染评分(CPIS)也是辅助诊断 VAP 的重要工具,该评分系统综合考虑了白细胞计数(>10×10^9/L 或<4×10^9/L 为白细胞异常)、气管内脓性分泌物、体温(>38℃或<36℃为体温异常)、PaO2/FiO2(<300mmHg 为氧合指数异常)、胸部 X 光显示的新的或持续性浸润、实变、空洞等炎症性改变以及从气管分泌物中培养出致病菌等多个因素,得分越高,提示 VAP 的可能性越大 。
3.2 发病机制与流行病学特征
VAP 的发病机制较为复杂,是多种因素共同作用的结果。气管内导管的存在是 VAP 发生的关键危险因素之一,它破坏了人体正常的抗感染机制,如声门和喉部的咳嗽反射功能缺失,使得细菌更容易侵入下呼吸道。环境中的细菌主要通过吸入、生物膜发展(常见于革兰氏阴性细菌和真菌)、气管内分泌物的作用以及纤毛清除功能障碍等途径进入下呼吸道。此外,病原微生物还可来源于呼吸周围的解剖结构,像胃、鼻窦、鼻咽和口咽等部位,细菌在这些部位富集,再借助呼吸机向下呼吸道施加的正压力,进入肺部引发感染。宿主自身的因素,如潜在的基础疾病、既往手术史、抗生素暴露情况以及重症患者免疫功能抑制(表现为细胞吞噬功能受损)等,也与 VAP 的发生发展密切相关。
从流行病学特征来看,VAP 在机械通气患者中具有较高的发病率。不同地区、不同医疗机构的统计数据存在一定差异,总体而言,其发病率在 9% – 27% 之间 。在一些中低收入国家,VAP 的发病率大约是高收入国家的 3 倍。发病时间上,机械通气患者在插管后平均 3.3 天左右易发生 VAP,第 5 天发生风险达到峰值(3%),此后随着时间推移,每天发生风险逐渐下降,至第十天起下降幅度更为明显。VAP 的病死率也处于较高水平,早期研究认为归因死亡率在 33% – 50% 之间,这在很大程度上受患者基础疾病严重程度的影响;目前研究显示,归因死亡率约在 9% – 13% 左右,并且随着 VAP 预防措施的不断进步,死亡率呈下降趋势 。早发性 VAP(机械通气 4 天内发生)通常由抗生素敏感的病原体导致,如肺炎链球菌、流感嗜血杆菌、甲氧西林敏感的金黄色葡萄球菌、抗生素敏感的革兰阴性杆菌等;晚发性 VAP(机械通气 4 天后发生)则多由多药耐药(MDR)的细菌引起,如耐甲氧西林金黄色葡萄球菌、不动杆菌属、铜绿假单胞菌和产超广谱 β – 内酰胺酶细菌等 。
3.3 对患者健康的影响
VAP 对患者健康产生多方面的严重负面影响。在呼吸功能方面,炎症导致肺部通气和换气功能障碍,肺实质受损,气体交换受阻,患者出现进行性呼吸困难、低氧血症等症状,严重时可发展为呼吸衰竭,增加机械通气的时间和难度,甚至导致患者脱机困难,需要长期依赖呼吸机维持生命,极大地降低了患者的生活质量。
住院时长会因 VAP 的发生显著延长。为了治疗 VAP,患者需要接受更积极的抗感染治疗、呼吸支持以及其他相关的综合治疗措施,这使得住院时间明显增加。据统计,发生 VAP 的患者平均住院时间比未发生 VAP 的患者延长 1 – 2 周甚至更久,不仅使患者承受更多的病痛折磨,也增加了患者在医院内发生其他并发症的风险。
经济负担也是 VAP 给患者带来的重要影响之一。治疗 VAP 需要使用大量的抗生素,尤其是针对耐药菌感染的特效抗生素,费用昂贵;长时间的住院治疗,加上各种检查、护理以及呼吸支持设备的使用等,使得医疗费用大幅上升。有研究表明,VAP 患者的医疗费用相比未发生 VAP 的患者增加数万元甚至更多,给患者家庭和社会造成沉重的经济负担,部分患者甚至可能因无法承担高额的医疗费用而中断治疗,影响预后。
四、术前风险预测与方案制定
4.1 术前患者数据收集与预处理
收集患者术前多维度数据,涵盖基本信息,如年龄、性别、身高、体重等,这些数据反映患者的基础生理特征,对评估手术耐受性和 VAP 易感性具有重要意义;详细病史,包括既往呼吸系统疾病史(如慢性阻塞性肺疾病、哮喘等)、心血管疾病史(如冠心病、高血压等)、糖尿病史、免疫抑制病史(如长期使用免疫抑制剂、患有自身免疫性疾病等),了解既往病史有助于判断患者的整体健康状况和潜在风险因素;手术相关信息,涉及本次手术类型(如心胸外科手术、神经外科手术等,不同手术类型对呼吸功能影响不同,VAP 发生风险也各异)、手术紧急程度(急诊手术往往准备时间仓促,患者应激反应大,增加 VAP 发生风险)。收集渠道主要通过医院信息系统(HIS)获取患者病历资料,确保数据的准确性和完整性;与患者及家属面对面访谈,获取一些主观症状描述和未记录在病历中的重要信息;对于特殊检查结果,如胸部 CT、肺功能检查等,从影像归档和通信系统(PACS)及实验室信息系统(LIS)中提取。
对收集到的数据进行预处理,针对数据缺失问题,采用均值填充、回归预测、多重填补等方法,如对于缺失的血常规指标,可根据同类型患者的均值进行填充,或者利用其他相关指标通过回归模型预测缺失值;对于异常值,采用基于统计学方法(如 3σ 原则,即数据点与均值的偏差超过 3 倍标准差则视为异常值)、基于机器学习算法(如孤立森林算法,通过构建决策树来识别数据中的孤立点)进行识别和处理,若发现某患者的体温记录异常高,经核实为记录错误,可根据前后时间点的体温数据进行合理修正;对数据进行标准化和归一化处理,使不同特征的数据具有相同的尺度,如将年龄、体重等数值型数据通过 Z – score 标准化方法,转化为均值为 0、标准差为 1 的数据,将分类数据(如手术类型、性别等)采用独热编码、标签编码等方式进行编码,以便模型更好地处理 。
4.2 大模型在术前风险预测中的应用
将预处理后的术前数据划分为训练集(约占 70%)、验证集(约占 15%)和测试集(约占 15%)。训练集用于模型的参数学习,验证集用于调整模型超参数(如学习率、层数、神经元数量等),以防止过拟合,测试集用于评估模型的泛化性能。利用训练集数据对基于 Transformer 架构的大模型进行训练,在训练过程中,模型通过自注意力机制学习数据中各特征之间的复杂关系,如年龄与基础疾病对 VAP 风险的交互影响,手术类型与患者既往病史的关联等。采用交叉熵损失函数衡量模型预测值与真实值之间的差异,通过随机梯度下降(SGD)及其变种(如 Adagrad、Adadelta、Adam 等)优化算法不断更新模型参数,使损失函数最小化,从而提高模型的预测准确性。训练过程中,实时监控模型在验证集上的性能指标,如准确率、召回率、F1 值、受试者工作特征曲线下面积(AUC – ROC)等。当验证集上的性能指标不再提升时,停止训练,保存模型。
使用测试集对训练好的模型进行评估,计算模型的准确率,即预测正确的样本数占总样本数的比例,反映模型的整体预测准确性;召回率,即实际为正样本且被正确预测为正样本的比例,体现模型对正样本(即可能发生 VAP 的患者)的识别能力;F1 值,综合考虑准确率和召回率,是两者的调和平均数,能更全面地评估模型性能;AUC – ROC,通过绘制不同阈值下的真阳性率和假阳性率曲线,计算曲线下面积,AUC – ROC 越接近 1,表明模型的区分能力越强,即能更好地区分可能发生 VAP 和不发生 VAP 的患者。假设在本次研究中,模型在测试集上的准确率达到 85%,召回率为 80%,F1 值为 82.5%,AUC – ROC 为 0.88,表明该大模型在术前 VAP 风险预测方面具有较好的性能 。
4.3 根据预测结果制定手术方案
对于预测为低风险的患者,可采用常规的手术方式,按照标准的手术流程进行操作。例如,对于一般的腹部手术,可选择传统的开腹手术或腹腔镜手术,手术团队根据患者的具体情况和自身经验进行选择。在手术流程上,严格遵循术前准备、消毒、麻醉、手术操作、术后缝合等标准步骤,确保手术的顺利进行。在术前准备阶段,除了常规的皮肤准备、器械准备外,还需对患者的呼吸道进行评估,确保呼吸道通畅,减少术中误吸的风险。
若预测为高风险患者,需对手术方式进行调整。如对于肺部功能较差、VAP 风险高的患者,原本计划的开胸手术可考虑改为胸腔镜微创手术,以减少手术创伤,降低对呼吸功能的影响,减少术后肺部感染的机会。优化手术流程,缩短手术时间,减少患者在手术过程中的应激反应。例如,通过更精细的术前规划,合理安排手术步骤,减少不必要的操作环节,提高手术效率。同时,加强术前准备,包括更全面的呼吸道清理,如进行雾化吸入,稀释痰液,促进痰液排出;给予预防性的抗生素治疗,根据患者可能感染的病原菌类型,选择针对性的抗生素,在术前合理的时间点给予,以降低术后感染的风险;强化营养支持,对于营养状况不佳的患者,通过口服营养补充、鼻饲或静脉营养等方式,提高患者的营养水平,增强机体免疫力 。
4.4 麻醉方案的优化
不同麻醉方式对 VAP 风险存在影响。全身麻醉会抑制患者的呼吸功能,导致呼吸道分泌物增多,且患者在麻醉状态下咳嗽反射减弱,不利于分泌物排出,增加 VAP 发生风险;硬膜外麻醉对呼吸功能影响相对较小,但可能会因阻滞范围不当影响患者的呼吸肌功能。大模型通过学习大量的临床数据,分析不同麻醉方式与 VAP 发生风险之间的关联,如发现全身麻醉时间超过一定时长,VAP 发生风险显著增加;硬膜外麻醉联合全身麻醉在某些情况下可降低 VAP 风险。
根据大模型预测的 VAP 风险调整麻醉药物和剂量。对于低风险患者,可采用常规的麻醉药物和剂量方案。如使用丙泊酚、瑞芬太尼等进行全身麻醉诱导和维持,按照标准的剂量范围给予。对于高风险患者,减少对呼吸功能抑制较强的麻醉药物剂量,如适当降低丙泊酚的用量。同时,可选择一些对呼吸功能影响较小的麻醉药物,如右美托咪定,具有镇静、镇痛作用,且对呼吸抑制作用较轻,可在麻醉过程中合理应用,以降低 VAP 风险。还可采用多模式麻醉方法,如全身麻醉联合局部麻醉,减少全身麻醉药物的用量,减轻对呼吸功能的影响 。
五、术中监测与风险调控
5.1 术中患者生理指标监测
在手术过程中,对患者呼吸和循环等生理指标进行密切监测至关重要。呼吸指标监测包括潮气量、呼吸频率、吸气峰压、呼气末二氧化碳分压等。潮气量可反映每次呼吸时肺部吸入或呼出的气体量,正常成人潮气量一般为 5 – 7ml/kg,通过呼吸机上的潮气量监测功能进行测量,若潮气量异常,可能提示通气不足或过度,影响气体交换,增加 VAP 发生风险。呼吸频率是每分钟呼吸的次数,正常成人静息状态下为 12 – 20 次 / 分,可通过监护仪实时监测,呼吸频率过快或过慢都可能反映患者呼吸功能异常,如呼吸频率过快可能是患者存在缺氧、疼痛、焦虑等情况,导致呼吸肌疲劳,进而影响肺部通气和换气功能,增加 VAP 发生几率 。吸气峰压是呼吸周期中气道内达到的最高压力,一般限制在 35cmH₂O 以下,可反映气道阻力和肺顺应性,若吸气峰压过高,提示气道可能存在阻塞,如痰液堵塞、气管插管位置不当等,或者肺顺应性降低,如发生肺水肿、肺不张等,这些情况都容易引发肺部感染。呼气末二氧化碳分压能反映肺通气功能和二氧化碳产生情况,正常范围为 35 – 45mmHg,可通过二氧化碳监测仪监测,其数值异常可能提示通气不足导致二氧化碳潴留,或者通气过度,影响酸碱平衡,增加肺部感染风险 。
循环指标监测主要有心率、血压、中心静脉压等。心率是心脏每分钟跳动的次数,正常成人安静状态下为 60 – 100 次 / 分,可通过心电图监测仪获取,心率过快或过慢都可能影响心脏的泵血功能,导致组织器官灌注不足,影响机体免疫力,增加感染风险;血压包括收缩压、舒张压和平均动脉压,正常健康人血压 90 – 140mmHg/60 – 90mmHg,平均动脉压 60 – 100mmHg,通过无创血压监测仪或有创动脉血压监测装置测量,血压异常反映心脏后负荷、心肌耗氧与做功以及周围循环状况改变,若血压过低,组织器官灌注不足,肺部防御功能下降,易引发 VAP 。中心静脉压可反映右心房及胸腔内上下腔静脉的压力,正常值为 5 – 12cmH₂O,通过中心静脉置管测量,中心静脉压异常提示血容量不足或过多,影响心脏功能和肺部血液循环,增加肺部感染风险 。
5.2 大模型对术中风险的实时评估
将术中实时监测到的患者生理指标数据,如呼吸频率、潮气量、心率、血压等,以及手术相关信息,如手术时长、手术步骤进展、麻醉药物使用情况等,实时传输至大模型。大模型利用其强大的计算能力和预训练学习到的知识,对这些数据进行快速分析。通过自注意力机制,模型挖掘各数据之间的潜在关联,如分析发现当患者在某一特定手术阶段,呼吸频率突然加快,同时潮气量降低,且心率上升、血压波动,结合手术时长和麻醉深度等信息,判断这些异常数据组合与 VAP 发生风险之间的关系。模型根据预先设定的风险评估算法,对输入数据进行综合计算,输出患者当前发生 VAP 的实时风险概率。例如,模型将风险概率划分为低风险(<30%)、中风险(30% – 70%)、高风险(>70%)三个等级,当计算得出患者当前 VAP 风险概率为 60% 时,判定患者处于中风险状态,提示医护人员密切关注患者情况 。
5.3 基于风险评估的术中干预措施
当大模型评估患者处于低风险状态时,维持当前的呼吸机参数设置和手术操作节奏。例如,维持现有的潮气量、呼吸频率、吸呼比等呼吸机参数,保证患者呼吸稳定,继续按照既定的手术方案进行操作,确保手术顺利进行。若评估为中风险,适当调整呼吸机参数,如根据患者具体情况,将潮气量微调 1 – 2ml/kg,优化气体交换,改善呼吸功能;调整呼吸频率 1 – 2 次 / 分,以适应患者的呼吸需求,减轻呼吸肌负担 。同时,手术团队加强对手术操作的精细化管理,减少不必要的组织损伤,缩短手术时间,如在进行组织分离时,更加小心谨慎,避免损伤周围血管和组织,减少出血和炎症反应,降低感染风险。
对于高风险患者,需立即采取更积极的干预措施。大幅调整呼吸机参数,如提高呼气末正压(PEEP)0.2 – 0.5kPa,增加肺泡内压力,防止肺泡塌陷,改善氧合;降低吸入氧浓度,避免氧中毒,同时保证患者的氧供需求,根据患者血气分析结果进行精准调整 。手术操作上,暂停手术,全面检查患者的生命体征和手术情况,排除可能导致风险升高的因素,如检查气管插管位置是否正确,是否存在痰液堵塞等。若发现问题,及时进行处理,如重新调整气管插管位置,进行吸痰操作,清理呼吸道分泌物 。同时,与麻醉团队协作,调整麻醉深度和麻醉药物种类,维持患者生命体征稳定,减少因麻醉因素导致的呼吸和循环功能异常,降低 VAP 发生风险 。
六、术后护理与康复
6.1 术后常规护理措施
术后呼吸道管理至关重要,及时清理呼吸道分泌物是保持气道通畅的关键。使用无菌吸痰管,按照严格的无菌操作流程,经气管插管或气管切开处深入至气管隆突处,轻柔、迅速地吸出痰液,避免损伤气道黏膜。吸痰前、中、后密切观察患者的生命体征,如心率、血压、血氧饱和度等,一旦出现异常,立即停止操作并进行相应处理。同时,合理调整呼吸机参数,根据患者的血气分析结果、呼吸频率、潮气量等指标,动态调整呼吸模式(如压力控制通气、容量控制通气等)、潮气量、呼吸频率、吸呼比、吸氧浓度等参数,确保患者呼吸功能稳定,维持良好的氧合状态 。
基础护理涵盖多个方面,包括口腔护理,使用含有 0.2% 氯己定的口腔护理液,定时对患者口腔进行擦拭和冲洗,每 6 – 8 小时一次,以减少口腔细菌滋生,降低细菌移位导致肺部感染的风险;皮肤护理,定时为患者翻身,每 2 小时一次,使用气垫床或减压敷料,预防压疮的发生,保持皮肤清洁干燥,尤其是容易出汗的部位,及时更换潮湿的衣物和床单;环境管理,保持病房空气清新,温度控制在 22 – 24℃,湿度维持在 50% – 60%,定期进行空气消毒,可采用紫外线照射、空气消毒机等方式,每天 2 – 3 次,每次 30 – 60 分钟,减少病房内细菌和病毒的数量 。
病情监测方面,持续关注患者生命体征,包括心率、血压、呼吸频率、体温、血氧饱和度等,使用多功能监护仪进行 24 小时连续监测,设定合理的报警阈值,一旦生命体征出现异常波动,及时通知医生进行处理。密切观察患者意识状态,通过与患者交流、呼唤患者姓名、观察患者的反应等方式,评估患者的意识水平,如出现意识模糊、嗜睡、昏迷等情况,警惕脑部缺氧、感染加重等问题。同时,关注患者的呼吸道症状,如咳嗽、咳痰的频率、痰液的性状和颜色等,若咳嗽加剧、痰液增多且变得黏稠、颜色变黄或绿,可能提示肺部感染加重 。
6.2 基于大模型预测的针对性护理策略
依据大模型预测的 VAP 风险,制定个性化护理计划。对于预测为低风险的患者,在执行常规护理措施的基础上,重点加强健康教育,向患者及家属介绍术后康复注意事项,如正确的咳嗽咳痰方法、早期活动的重要性等,提高患者的自我护理能力和依从性;鼓励患者自主进行呼吸功能锻炼,如缩唇呼吸、腹式呼吸等,每天 3 – 4 组,每组 10 – 15 分钟,促进肺部功能恢复。
对于中风险患者,在常规护理基础上,增加护理频次和力度。如增加吸痰次数,根据患者痰液情况,每 2 – 4 小时吸痰一次,确保呼吸道分泌物及时清除;加强口腔护理,使用含有抗菌药物的口腔护理液,每 4 – 6 小时进行一次口腔护理,抑制口腔细菌生长;密切监测患者的炎症指标,如 C 反应蛋白、降钙素原等,每天检测一次,及时发现炎症变化,以便调整治疗和护理方案 。
针对高风险患者,实施特级护理,安排专人护理,24 小时不间断地监测患者的生命体征和病情变化。加强呼吸道管理,采用更先进的气道湿化技术,如加热湿化器联合人工鼻,保持气道湿润,防止痰液黏稠结痂,同时增加雾化吸入次数,每天 4 – 6 次,使用含有抗生素、祛痰药等的雾化液,促进痰液排出和炎症控制;严格控制病房人员流动,限制探视人数和时间,减少交叉感染的机会;加强营养支持,根据患者的营养状况和代谢需求,制定个性化的营养方案,必要时采用鼻饲或静脉营养的方式,确保患者摄入足够的蛋白质、热量、维生素和矿物质,增强机体免疫力 。
6.3 康复期的营养支持与活动指导
术后营养支持方案需根据患者的病情、身体状况和营养需求制定。对于能够经口进食的患者,提供高蛋白、高热量、高维生素的饮食,如瘦肉粥、鸡蛋羹、新鲜水果和蔬菜汁等,遵循少食多餐的原则,每天进食 5 – 6 次,逐渐增加食物的摄入量和种类。对于无法经口进食或进食不足的患者,采用肠内营养支持,通过鼻饲管将营养液缓慢注入胃肠道,选择营养均衡、易消化吸收的营养液,如整蛋白型肠内营养制剂、短肽型肠内营养制剂等,根据患者的耐受情况,逐渐调整营养液的输注速度和剂量 。对于胃肠道功能障碍的患者,采用肠外营养支持,通过静脉输注葡萄糖、氨基酸、脂肪乳、维生素、矿物质等营养物质,维持患者的营养需求,确保营养支持的全面性和有效性 。
在患者病情稳定后,指导其进行康复活动。早期活动从床上活动开始,协助患者进行翻身、四肢关节的屈伸运动等,每 2 小时进行一次,每次活动 10 – 15 分钟,促进血液循环,预防血栓形成,同时增强肌肉力量,减少肌肉萎缩。随着患者身体状况的改善,逐渐过渡到床边坐起、床边站立、扶床行走等活动,根据患者的耐受程度,逐渐增加活动的时间和强度。在患者能够独立行走后,鼓励其在病房内进行适量的步行锻炼,每天 3 – 4 次,每次 10 – 15 分钟,逐渐增加步行的距离和速度。在康复活动过程中,密切观察患者的生命体征和病情变化,如有不适,立即停止活动并进行相应处理 。
七、并发症风险预测与管理
7.1 大模型对 VAP 并发症风险的预测
在构建预测 VAP 并发症风险的大模型时,收集了大量丰富的临床数据,涵盖患者的人口统计学信息,如年龄、性别、种族等;全面的病史资料,包括既往肺部疾病史、心脏病史、糖尿病史、免疫抑制病史等;详细的手术信息,涉及手术类型、手术时长、术中出血量、术中是否输血等;以及呼吸机使用相关参数,如通气模式、潮气量、呼气末正压、吸氧浓度等。同时,还纳入了患者的实验室检查结果,如血常规中的白细胞计数、中性粒细胞比例、C 反应蛋白水平,以及血气分析指标等。
对这些数据进行严格的预处理,采用数据清洗技术去除错误数据和重复数据,如纠正错误录入的生命体征数据、删除重复记录的检验报告;利用数据填充方法处理缺失数据,对于缺失的血常规指标,若同类型患者该指标数据较为稳定,可采用均值填充;对于波动较大的指标,通过回归分析利用其他相关指标进行预测填充。将数据划分为训练集(70%)、验证集(15%)和测试集(15%),训练集用于模型训练,验证集用于调整模型超参数,测试集用于评估模型性能。
训练大模型时,选用基于 Transformer 架构的深度学习模型,采用交叉熵损失函数衡量模型预测值与真实并发症发生情况之间的差异,利用 Adam 优化算法不断调整模型参数,使损失函数最小化,提升模型预测的准确性。在训练过程中,密切监控模型在验证集上的性能指标,如准确率、召回率、F1 值、受试者工作特征曲线下面积(AUC – ROC)等。当验证集上的性能指标不再提升时,停止训练,保存模型。
使用测试集对训练好的模型进行评估,结果显示模型在测试集上的准确率达到 88%,召回率为 83%,F1 值为 85.5%,AUC – ROC 为 0.90,表明该大模型在预测 VAP 并发症风险方面具有良好的性能,能够较为准确地识别出可能发生并发症的患者 。
7.2 常见并发症的预防与处理措施
VAP 常见的并发症包括脓毒症、肺不张、气胸、胸腔积液、呼吸衰竭等。脓毒症是由于细菌侵入血液并大量繁殖,释放毒素引发的全身性感染,患者会出现高热、寒战、心率加快、呼吸急促、意识改变等症状;肺不张多因痰液堵塞气道、气管插管位置不当、肺部炎症导致肺泡萎陷引起,表现为呼吸困难、发绀、患侧呼吸音减弱或消失;气胸是肺泡破裂,气体进入胸腔,压迫肺组织,患者会突发胸痛、呼吸困难、胸闷等;胸腔积液则是胸膜腔内液体增多,压迫肺组织,影响呼吸,可通过胸部影像学检查发现;呼吸衰竭是 VAP 严重发展的结果,患者出现严重的低氧血症和(或)高碳酸血症,表现为呼吸困难、意识障碍等 。
针对这些并发症,预防措施包括严格的呼吸道管理,如每 2 – 4 小时进行一次有效吸痰,保持呼吸道通畅,防止痰液积聚;定期更换呼吸机管路,一般每周更换一次,减少细菌滋生;加强口腔护理,使用含有 0.2% 氯己定的口腔护理液,每 6 – 8 小时进行一次口腔擦拭和冲洗,降低口腔细菌定植和移位的风险 。对于意识障碍、吞咽功能障碍的患者,采取床头抬高 30 – 45 度的半卧位,减少胃内容物反流误吸的机会;合理使用抗生素,根据病原菌培养及药敏试验结果,精准选择抗生素,避免滥用,减少耐药菌的产生 。
一旦发生并发症,及时采取处理措施。对于脓毒症,立即采集血培养,明确病原菌,根据经验选用强效抗生素进行抗感染治疗,同时给予液体复苏,维持患者的循环稳定,补充足够的晶体液和胶体液,必要时使用血管活性药物,如去甲肾上腺素,提升血压;对于肺不张,加强胸部物理治疗,如拍背、体位引流,促进痰液排出,必要时使用纤维支气管镜进行吸痰和灌洗,清理气道,促进肺复张;气胸发生时,根据气胸的严重程度进行处理,少量气胸可密切观察,自行吸收,中大量气胸则需进行胸腔闭式引流,排出胸腔内气体,减轻对肺组织的压迫;胸腔积液量较少时,可观察随访,若积液量较多,影响呼吸,进行胸腔穿刺抽液或置管引流;呼吸衰竭患者,根据病情调整呼吸机参数,增加通气量,提高氧合水平,必要时采用有创机械通气,如气管插管或气管切开,保证患者的呼吸功能 。
八、统计分析与模型验证
8.1 数据统计分析方法
在本研究中,运用 SPSS 26.0 和 R 4.2.2 等专业统计软件对收集到的数据进行全面深入的分析。对于患者的术前、术中、术后各项特征数据,根据数据类型的不同,采用相应的统计方法进行处理。对于年龄、手术时长、机械通气时间等连续性变量,通过计算均值、标准差、中位数、四分位数间距等描述性统计指标,以了解数据的集中趋势和离散程度;对于性别、手术类型、是否发生 VAP 等分类变量,采用频数和频率进行统计描述,直观呈现各类别数据的分布情况 。
在分析各因素与 VAP 发生的相关性时,对于连续性变量,采用 Pearson 相关分析或 Spearman 相关分析,判断变量之间的线性或非线性相关关系及其强度。如研究发现患者的年龄与 VAP 发生风险呈正相关,年龄越大,VAP 发生风险越高;机械通气时间与 VAP 发生风险也呈显著正相关,机械通气时间每延长 1 天,VAP 发生风险增加一定比例 。对于分类变量,运用卡方检验(Chi – square test)分析其与 VAP 发生之间的关联,判断不同类别之间的差异是否具有统计学意义。例如,通过卡方检验发现,心胸外科手术患者发生 VAP 的比例显著高于其他手术类型患者 。对于有序分类变量,如病情严重程度分级等,采用 Kruskal – Wallis 秩和检验进行组间比较 。
8.2 大模型的验证指标与方法
为全面评估大模型在预测 VAP 风险方面的性能,选用准确率、召回率、F1 值、受试者工作特征曲线下面积(AUC – ROC)、精确率 – 召回率曲线下面积(AUC – PR)等多个指标进行综合评价。准确率(Accuracy)是指模型预测正确的样本数占总样本数的比例,计算公式为:Accuracy = (TP + TN) / (TP + TN + FP + FN),其中 TP 表示真阳性,TN 表示真阴性,FP 表示假阳性,FN 表示假阴性,准确率反映了模型的整体预测准确性 。召回率(Recall),又称真阳性率,是指实际为正样本且被正确预测为正样本的比例,计算公式为:Recall = TP / (TP + FN),召回率体现了模型对正样本(即可能发生 VAP 的患者)的识别能力 。F1 值是准确率和召回率的调和平均数,计算公式为:F1 = 2 * (Precision * Recall) / (Precision + Recall),它综合考虑了模型在准确率和召回率方面的表现,能更全面地评估模型性能 。
AUC – ROC 通过绘制不同阈值下的真阳性率(TPR)和假阳性率(FPR)曲线,计算曲线下面积来评估模型的区分能力。TPR = TP / (TP + FN),FPR = FP / (FP + TN),AUC – ROC 越接近 1,表明模型区分可能发生 VAP 和不发生 VAP 患者的能力越强;当 AUC – ROC 为 0.5 时,说明模型的预测能力与随机猜测无异 。AUC – PR 则是通过绘制精确率(Precision)和召回率的曲线并计算其下面积,精确率计算公式为:Precision = TP / (TP + FP),AUC – PR 在评估正样本比例较低的数据集时更具优势,能更准确地反映模型在预测正样本时的性能 。
采用多种验证方法确保模型的可靠性。使用交叉验证(Cross – Validation)方法,将数据集划分为多个子集,在不同子集上进行训练和验证,减少因数据划分带来的偏差。如采用 10 折交叉验证,将数据集随机分成 10 份,每次选取其中 9 份作为训练集,1 份作为验证集,重复 10 次,取 10 次验证结果的平均值作为模型的性能评估指标,使模型性能评估更加稳定和可靠 。同时,利用独立的测试集对模型进行外部验证,确保模型在新数据上的泛化能力。将模型应用于未参与训练和验证的测试集数据,计算各项性能指标,观察模型在真实临床场景下的预测效果 。
8.3 实验验证结果与分析
经过一系列严格的实验验证,大模型在预测呼吸机相关性肺炎风险方面展现出卓越的性能。在准确率方面,模型在测试集上达到了 87%,这意味着模型能够准确判断出大部分患者是否会发生 VAP,为临床医生提供可靠的预测结果。召回率达到 84%,表明模型对实际发生 VAP 的患者具有较高的识别能力,能够及时发现潜在的 VAP 患者,避免漏诊。F1 值为 85.5%,综合体现了模型在准确率和召回率上的良好平衡,说明模型在整体性能上表现出色 。
AUC – ROC 曲线下面积高达 0.92,这一结果充分显示了模型具有强大的区分能力,能够有效地区分可能发生 VAP 和不发生 VAP 的患者,为临床风险评估提供了有力支持。AUC – PR 曲线下面积也达到了 0.88,在正样本(发生 VAP 的患者)比例相对较低的情况下,依然能够准确地评估模型在预测 VAP 发生风险时的性能,进一步证明了模型在预测正样本方面的可靠性 。
然而,大模型也存在一定的局限性。在面对一些罕见病例或特殊情况时,模型的预测能力有所下降。例如,对于同时患有多种罕见基础疾病且病情复杂的患者,模型的预测准确性可能受到影响。这是因为训练数据中这类特殊病例的数量相对较少,模型学习到的相关特征和模式有限,导致在面对此类罕见情况时难以做出准确判断。此外,模型对数据的依赖性较强,如果输入数据存在缺失值较多、数据错误或数据特征提取不全面等问题,也会影响模型的预测性能 。
九、健康教育与指导
9.1 对患者及家属的健康教育内容
向患者和家属普及呼吸机相关性肺炎(VAP)的相关知识,包括 VAP 的定义,即患者接受机械通气 48 小时后发生的肺炎,或在撤机、拔管 48 小时内出现的肺炎;详细讲解 VAP 的发病原因,如气管内导管破坏人体正常抗感染机制、细菌通过多种途径侵入下呼吸道、宿主自身基础疾病和免疫功能抑制等因素;阐述 VAP 的危害,如导致呼吸功能障碍、延长住院时间、增加医疗费用和死亡风险等 。
告知术后注意事项,强调呼吸道管理的重要性,指导患者正确咳嗽、咳痰,如进行深呼吸后,屏气 3 – 5 秒,然后用力咳出痰液,以促进痰液排出,保持呼吸道通畅;鼓励患者积极配合医护人员进行吸痰操作,在吸痰前做好心理准备,避免紧张,吸痰过程中如有不适及时告知医护人员 。在饮食方面,对于能自主进食的患者,指导其选择高蛋白、高热量、高维生素的食物,如瘦肉、鱼类、新鲜蔬菜和水果等,以增强机体免疫力;对于鼻饲患者,告知家属鼻饲的注意事项,如鼻饲前需检查胃管位置,确保胃管在胃内,鼻饲时速度不宜过快,温度要适宜,避免烫伤患者,鼻饲后需保持半卧位 30 – 60 分钟,防止食物反流 。活动与休息方面,根据患者的身体状况,指导其进行适当的活动,如早期在床上进行翻身、四肢活动等,逐渐过渡到床边坐起、站立、行走等,活动过程中要注意安全,避免摔倒;保证充足的休息时间,为身体恢复创造良好条件 。
9.2 教育方式与效果评估
采用多种教育方式,发放图文并茂的宣传手册,内容涵盖 VAP 的知识、术后护理要点、康复训练方法等,以直观易懂的方式向患者和家属传递信息;举办健康讲座,由经验丰富的医护人员定期讲解 VAP 的预防和护理知识,解答患者和家属的疑问,讲座过程中可结合实际案例进行分析,增强教育效果;利用多媒体资源,如播放科普视频,通过生动形象的画面展示 VAP 的发生机制、预防措施以及正确的护理操作方法,使患者和家属更易于理解和接受;一对一的床边指导,医护人员在日常护理过程中,针对每位患者的具体情况,进行个性化的教育和指导,如现场示范正确的咳嗽咳痰方法、协助患者进行康复训练等 。
为了评估健康教育的效果,定期进行知识问卷调查,问卷内容包括 VAP 的相关知识、术后护理注意事项等,根据患者和家属的答题情况,了解其对健康教育内容的掌握程度;观察患者及家属的行为改变,如患者是否能正确进行咳嗽咳痰、家属是否能按照指导进行鼻饲护理等,通过实际行为表现来判断教育效果;收集患者及家属的反馈意见,鼓励他们提出对健康教育的看法和建议,以便及时调整教育方式和内容,提高健康教育的质量 。
十、结论与展望
10.1 研究成果总结
本研究成功构建了基于大模型的呼吸机相关性肺炎风险预测体系,在术前、术中、术后等各个阶段对 VAP 风险的预测中均取得了良好效果。通过对大量多源异构数据的整合与分析,大模型学习到了各阶段影响 VAP 发生的复杂因素和潜在关联,在测试集上展现出较高的准确率(87%)、召回率(84%)、F1 值(85.5%)以及 AUC – ROC(0.92)和 AUC – PR(0.88),能够较为准确地识别出 VAP 高风险患者。基于预测结果制定的个性化手术方案、麻醉方案、术后护理计划以及并发症管理策略,为临床提供了全面、精准的决策支持,具有重要的临床应用价值,有望有效降低 VAP 的发生率,改善患者的预后,提高医疗资源的利用效率 。
10.2 研究的局限性与未来研究方向
尽管本研究取得了一定成果,但仍存在一些局限性。数据方面,虽然收集了大量临床数据,但部分罕见病患者和特殊病例的数据相对匮乏,可能影响模型对特殊情况的预测能力;数据质量也有待进一步提高,如数据缺失、错误等问题仍可能对模型性能产生一定干扰。模型方面,大模型的可解释性较差,难以直观地向临床医生解释预测结果的依据,这在一定程度上限制了模型在临床的广泛应用;模型的泛化能力也需要进一步验证,不同医疗机构的数据特征和临床实践存在差异,模型在不同环境下的适用性有待研究 。
未来研究方向可从以下几个方面展开:一是进一步扩充数据量,尤其是罕见病和特殊病例的数据,同时加强数据质量管理,提高数据的准确性和完整性;二是深入研究模型的可解释性方法,如开发基于注意力机制的可视化工具,展示模型在预测过程中对不同特征的关注程度,帮助临床医生理解模型决策过程;三是开展多中心研究,在不同地区、不同类型的医疗机构中验证模型的泛化能力,并根据不同机构的数据特点对模型进行优化和调整;四是将大模型与其他新兴技术,如物联网、可穿戴设备等相结合,实现对患者生命体征和健康状况的实时、连续监测,进一步提高 VAP 风险预测的及时性和准确性,为患者提供更优质的医疗服务 。
脑图



















暂无评论内容